عملکرد سنتی باتری در محفظه موتور به خوبی شناخته شده است: بدون باتری نمی توان وسیله نقلیه را راه اندازی کرد. علاوه بر موتور استارت ، شمع ، شمع گرمکن ، چراغ ها و برنامه های الکترونیکی همه به انرژی الکتریکی احتیاج دارند.
اما باتری چگونه ساخته می شود و چگونه کار می کند؟
باتری های اسید سرب: قطعات و ساختار
بسیاری از رانندگان هنگام خرید جدید ، از وزن سنگین باتری خودرو آگاه می شوند. وزن باتری از حدود 10.5 کیلوگرم ، تا 30 کیلوگرم متغیر است. دلیل این امر صفحات سربی است که در سلولهای باتری استفاده شده است.
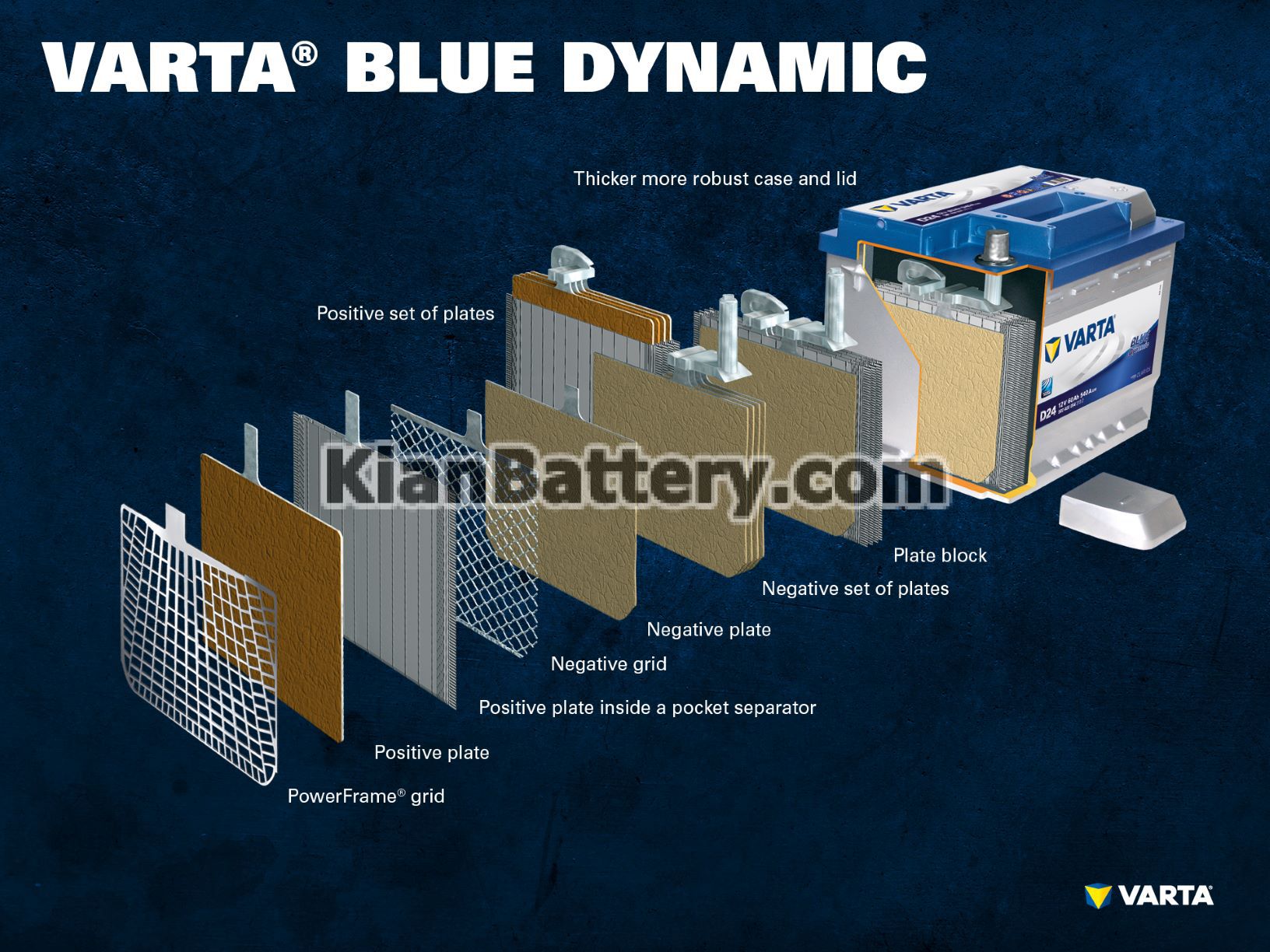
قطعات و ساختار سلول باتری
الکترود مثبت:
صفحه مثبت: در باتری سرب اسیدی ، صفحه با بار مثبت (ماده فعال) از اکسید سرب (PbO2) تشکیل شده است که در یک الکترولیت غوطه ور است.
شبکه مثبت: شبکه مثبت از آلیاژ سرب تشکیل شده است و برای نگه داشتن ماده فعال و به عنوان یک جمع کننده فعلی استفاده می شود.
الکترود منفی:
صفحه منفی: صفحه با بار منفی (ماده فعال) از سرب خالص (Pb) تشکیل شده است ، که در یک الکترولیت نیز فرو رفته است.
شبکه منفی: این نیز مانند صفحه مثبت ، از آلیاژ سرب تشکیل شده و در همان هدف نیز بکار گرفته می شود.
الکترولیت ترکیبی از اسید سولفوریک (H2SO4) و آب مقطر است. این الکترولیت می تواند به صورت مایع (مانند باتری های مرطوب معمولی یا در فن آوری پیشرفته EFB) ، یا به شکل ژل باشد یا در یک نمد شیشه ای محدود شود (مانند فن آوری AGM).
چندین الکترود مثبت، دسته صفحه مثبت را تشکیل می دهند و چندین الکترود منفی دسته صفحه منفی را تشکیل می دهند. با هم ، یک صفحه منفی و یک صفحه مثبت یک بلوک صفحه را تشکیل می دهند که هر بلوک داخل یک سل باتری قرار داده می شود.
یک باتری استارت معمولی از 6 سلول متصل به سری است که هر کدام دارای ولتاژ اسمی 2 ولت هستند که در صورت شارژ کامل باتری ، ولتاژ دقیقا 12.72 ولت حاصل می شود. ظرفیت و قابلیت آمپر سرد باتری از تعداد صفحات در هر سلول ناشی می شود.
سلول ها در یک محفظه قرار دارند که از پلاستیک مقاوم در برابر اسید (پلی پروپیلن) ساخته شده است. در یک باتری SLI معمولی ، این با یک پوشش با یک سیستم لایبرنیت بسته می شود که مانع از خروج مایع از باتری می شود و مایع را از گاز جدا می کند.
باتری های اولیه دارای سل های پیچ دار بودند که می بایستی آب باتری هر چند وقت به آن اضافه میشد. اما باتری های کنونی از نوع سیلد هستند و نیاز به ریختن آب باتری ندارند.
عملکرد باتری اتومبیل: انرژی شیمیایی به انرژی الکتریکی تبدیل می شود.
باتری ماشین انرژی را به صورت شیمیایی ذخیره می کند و آن را به انرژی الکتریکی تبدیل می کند. در این فرآیند الکترو شیمیایی ، چهار ماده با یکدیگر واکنش نشان می دهند:
هیدروژن (H)
اکسیژن (O2)
سرب (Pb)
سولفور (S)
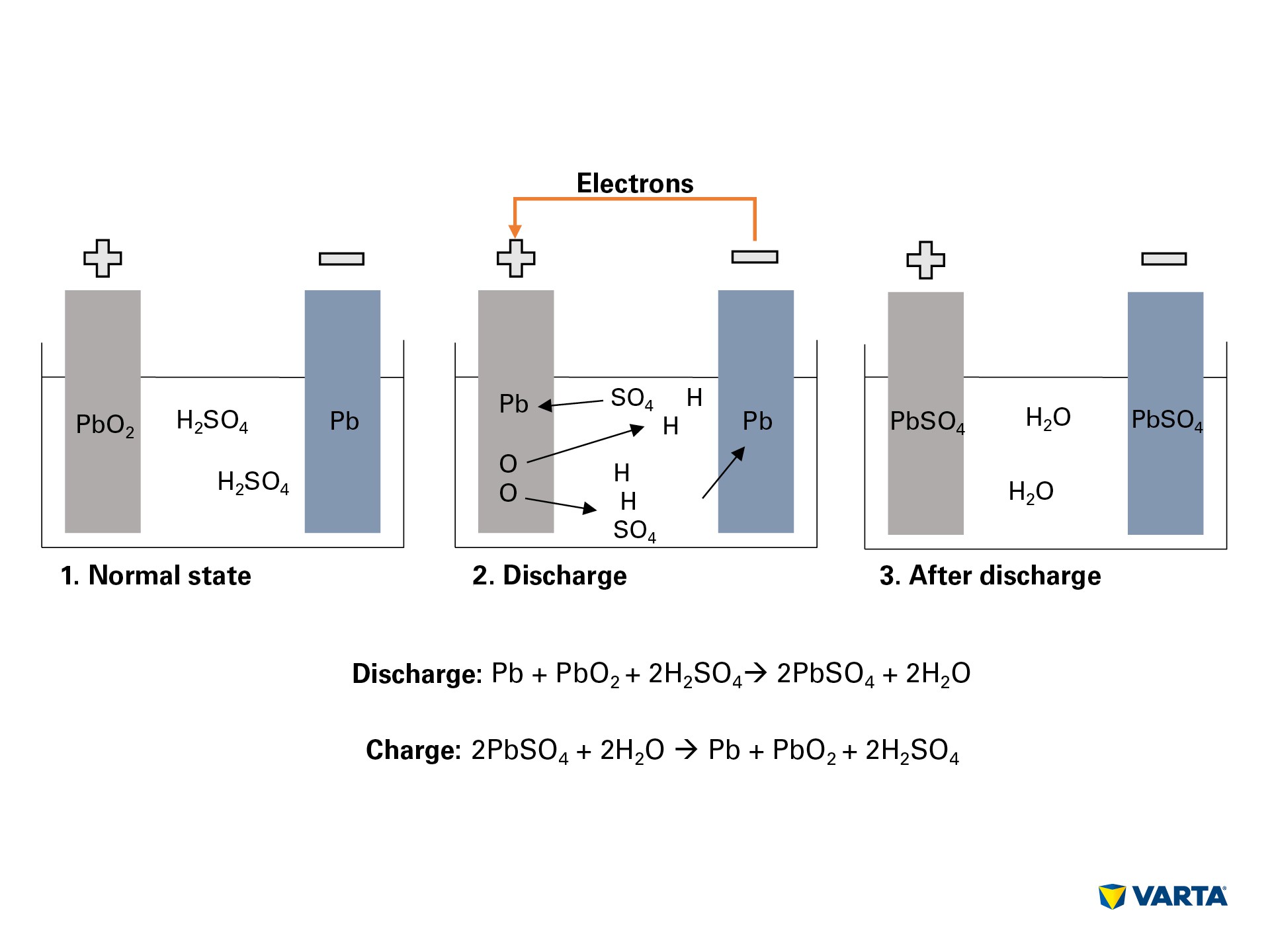
اتصال مصرف کننده خارجی ، واکنش شیمیایی موجود در باتری را شروع می کند:
الکترولیت ، ترکیبی از اسید سولفوریک (H2SO4) و آب مقطر به یون های هیدروژن با بار مثبت (H +) و یون های سولفات با بار منفی (SO42-) تبدیل می شود.
در همان زمان ، الکترونها (2e-) از منفی به الکترود مثبت از طریق مصرف کننده خارجی حرکت می کنند.
برای جبران این جریان الکترون ها ، یون های سولفات از الکترولیت به الکترود منفی حرکت می کنند ، جایی که با سرب (Pb) واکنش نشان می دهند تا سولفات سرب (PbSO4) تولید کنند.
سولفات سرب نیز در الکترود مثبت تولید می شود: پیوند اکسیژن (O2) در اکسید سرب (PbO2) با انتقال الکترون شکسته می شود و اکسیژن به داخل الکترولیت منتقل می شود.
سرب باقی مانده (سرب) با سولفات (SO4) از الکترولیت پیوند می یابد.
در آنجا اکسیژن با هیدروژن پیوند می یابد تا آب (H2O) تشکیل شود. از آنجا که از اسید سولفوریک با تشکیل سولفات سرب استفاده می شود ، غلظت محلول الکترولیت کاهش می یابد. هنگامی که غلظت اسید سولفوریک به زیر سطح مشخصی سقوط کند ، باید باتری آن را شارژ کرد.
در حین شارژ ، فرآیندهای شیمیایی به ترتیب معکوس انجام می شوند. در انتها می توان عناصر اصلی را یافت: الکترود مثبت از سولفات سرب (PbSO4) تشکیل شده است ، الکترود منفی از سرب خالص (Pb) و الکترولیت متشکل از اسید سولفوریک رقیق (H2SO4) است. از آنجا که این فرایند تبدیل با ضرر همراه است ، یک باتری تنها می تواند تعداد محدودی از چرخه های شارژ را تحمل کند. بنابراین عمر مفید آن محدود است.
فرمول :
Discharge: Pb + PbO2 + 2H + 2HSO4 —-> 2PbSO4 + 2H2O
Charge: 2PbSO4 + 2H2O —-> Pb + PbO2 + 2H2SO4
مشکلات باتریهای اسید سرب: سولفاته شدن و لایه بندی اسیدها
اگر یک باتری با ولتاژ خیلی کم شارژ شود ، اسید موجود در الکترولیت به دلیل اختلاط ضعیف طبقه بندی می شود. تراکم های مختلف، باعث لایه بندی اسید سولفوریک در قسمت پایین و آب در قسمت بالای باتری می شود. به همین دلیل ، تنها بخش میانی الکترولیت ، یعنی فقط یک سوم الکترولیت، می تواند برای فرآیند تخلیه و شارژ مورد استفاده قرار گیرد.
علت احتمالی لایه بندی اسیدها عمدتا سفرهای کوتاه با استفاده همزمان تعداد زیادی از بخش های خودرو هست که برق مصرف می کنند. در این حالت ، آلترناتور زمان کافی برای شارژ مجدد باتری را ندارد.

نتیجه لایه بندی اسید سولفات است.
اگر این اتفاق در باتری رخ دهد ، یا اگر مرتباً در حد کافی شارژ نشود ، سولفات سرب (PbSO4) روی الکترودها متبلور می شود که در طی زمان ساختارهای بلوری بزرگتری را تشکیل می دهند. این فرایند به عنوان “سولفاته” شناخته می شود. بلوری شدن (کریستالیزه شدن) از تبدیل مجدد سولفات سرب به عناصر اصلی سرب یا اکسید سرب جلوگیری می کند ، که منجر به جلوگیری از پذیرش بار و کاهش قدرت جریان هوای سرد CCA می شود.
سولفاته شدن همچنین ممکن است به لایه جداکننده (separators) آسیب برساند و یا باعث اتصال کوتاه در سلول شود.
برای خنثی کردن این تأثیر و جلوگیری از خرابی زودرس باتری ، هیچگاه نباید یک باتری در طی مدت طولانی در حالت کم شارژ نگهداری شود. به همین منظور توصیه می شود باتری را به طور مرتب تست کنید و در صورت لزوم آن را به طور کامل شارژ کنید.
فن آوری های جدید باتری: AGM و یون لیتیوم
تاکنون ، باتری های معمولی اسید سرب سهم بالایی از بازار را به خود اختصاص داده اند.
با این حال ، بازار به سرعت در حال تغییر است: در فن آوری های نو مثل خودروهای مجهز به سامانه خاموش-روشن از باتریهایی مانند AGM استفاده می کنند که باعث ایجاد ثبات در چرخه بیشتر و تضمین عملکرد قابل اعتماد در وسایل نقلیه با افزایش انرژی مورد نیاز می شوند.
یکی دیگر از مزایای AGM این است که لایه بندی اسید داخل باتری اتفاق نمی افتد.
نسل جدیدی از باتری های اتومبیل برای وسایل نقلیه میکرو هیبریدی با ولتاژ 48 ولت عمل می کند و از سلول هایی با فناوری یون لیتیوم استفاده می کنند.
چگونه ساختار داخلی باتری خودرو (از جمله نوع الکترولیت، صفحات سربی و طراحی ترمینالها) بر عملکرد آن در شرایط مختلف (مانند شروع سرد یا رانندگی طولانیمدت) تأثیر میگذارد و چه ویژگیهایی در طراحی باتری باعث بهبود کارایی و عمر آن میشوند؟
با سلام
ساختار داخلی باتری خودرو و اجزای آن، به ویژه نوع الکترولیت، صفحات سربی و طراحی ترمینالها، تأثیر بسزایی بر عملکرد باتری در شرایط مختلف دارد. در اینجا به بررسی جزئیات این عوامل و ویژگیهایی که میتوانند بهبود عملکرد و عمر باتری را فراهم کنند، میپردازیم.
1. نوع الکترولیت
الکترولیت مایع، الکترولیت ژل یا AGM:
ادغام مایع: در باتریهای سنتی، الکترولیت مایع (مخلوطی از آب و سولفوریک اسید) به شدت تحت تأثیر دما و وضعیت شارژ قرار میگیرد. در شرایط سرد، از آنجا که فعالیت شیمیایی کاهش مییابد، باتری به سختی شروع به کار میکند.
الکترولیت ژل و AGM: این نوعها معمولاً در دماهای نمای بیشتری از خود نشان میدهند. آنها در برابر دماهای شدید مقاومت بیشتری دارند و خطر نشت و تبخیر الکترولیت را کاهش میدهند.
2. صفحات سربی
ابعاد و طراحی صفحات:
صفحات بزرگتر: صفحات بزرگتر عموماً سطح بیشتری برای واکنش شیمیایی ایجاد میکنند، که میتواند در افزایش توان باتری در شرایط استارت سرد یا بارگذاری سنگین مؤثر باشد.
طراحی مشبک: صفحات مشبک میتوانند جریان الکتریکی را بهبود بخشند، در حالی که کاهش وزن کلی باتری را فراهم میکنند. این طراحی میتواند به کاهش مقاومت داخلی و افزایش کارایی کمک کند.
نوع سرب:
صفحاتی که با روشهای خاصی از سرب تولید میشوند (مثل سرب محصوص و آلیاژهای خاص) میتوانند مقاومت به خوردگی بهتری از خود نشان دهند و در نتیجه عمر باتری را افزایش دهند.
3. طراحی ترمینالها
طراحی و جنس ترمینالها:
ترمینالهای بزرگ و از جنسی مقاوم در برابر خوردگی مانند مس نیکل پوششدهی شده، میتوانند جریان را بهتر و با مقاومت کمتری منتقل کنند و به این ترتیب از کاهش عملکرد در شرایط بارگذاری و دما جلوگیری کنند.
طراحی مناسب ترمینالها میتواند از خطرات ناشی از تماسهای ضعیف و گرمشدگی ناخواسته جلوگیری کند.
4. تأثیر بر عملکرد در شرایط مختلف
شروع سرد:
در هوای سرد، عملکرد باتری به شدت تحت تأثیر دما و نوع الکترولیت قرار میگیرد. باتریای که الکترولیت ژل یا AGM داشته باشد، به احتمال زیاد در стартهای سرد بهتر عمل میکند. همچنین، صفحات بزرگتر و قویتر میتوانند توان استارت بیشتری فراهم کنند.
رانندگی طولانیمدت:
در مدت رانندگی طولانی، باتری باید بهطور مداوم شارژ شود. در این شرایط، باتریهایی با طراحی بهینهسازیشده صفحات و توانایی حفظ شارژ (مانند AGM یا باتریهای تیتانیومی) به بهترین شکل عمل میکنند.
5. ویژگیهای بهبود دهنده کارایی و عمر باتری
سیستمهای مدیریت باتری: باتریهایی که دارای سیستم مدیریت داخلی برای کنترل چرخه شارژ و دشارژ هستند، میتوانند عمر باتری را افزایش دهند و از آسیبهای ناشی از شارژ بیش از حد یا تخلیه عمیق جلوگیری کنند.
پوششهای مقاوم: باتریهایی که با پوششهایی مقاوم در برابر حرارت و رطوبت پوشش داده شدهاند، میتوانند در شرایط سختتر کارایی بهتری داشته باشند.
تکنولوژی پیشرفته: استفاده از فناوریهای نوین مانند باتریهای لیتیومی یا مواد پیشرفته در ساخت صفحات و الکترولیتها میتواند به کاهش وزن، افزایش کارایی و بهبود عمر باتری منجر شود.
در نتیجه ساختار داخلی باتری خودرو و طراحی اجزای مختلف آن به شدت بر عملکرد و عمر مفید آن تأثیرگذار است. با انتخاب باتریهای طراحیشده با دقت و تکنولوژیهای پیشرفته، میتوان عمر و کارایی باتری خودرو را به طرز قابل توجهی افزایش داد.
کیان باتری بزرگترین استارتآپ تخصصی باتری خودرو در کشور است که به صورت شبانه روزی به حمل و نصب رایگان باتری خودرو در محل مشتری می پردازد.
ما در این مجموعه سعی کرده ایم بهترین محصولات تولیدی داخل کشور را از هر تولیدکننده جمع آوری نموده و با ارائه یک سبد فروش متنوع، به صورت همزمان در اختیار مشتریان خود قرار دهیم.
شما می توانید جهت کسب اطلاعات بیشتر به صورت شبانه روزی با کارشناسان فروش مجموعه کیان باتری به شماره تلفن 88882222-021 تماس حاصل نموده، سوالات خود را مطرح کنید و مشاوره دریافت نمایید.
من اگر بخواهم برای ماشینم باتری بگیرم، چه مدل باتری باید بخرم و از کجا بفهمم خوب است یا نه؟ قیمتش هم زیاد نباشه! راستی باتری قدیمی مو چیکار کنم؟
با سلام
مجموعه کیان باتری یک استارتاپ تخصصی تعویض شبانه روزی باتری خودرو در محل مشتری است که توانسته است بهترین محصولات تولید شده در داخل کشور را جمع آوری کرده و همزمان به مشتریان خود ارائه نماید.
شما می توانید جهت کسب اطلاعات بیشتر در این زمینه و اطلاع از انواع محصولات موجود به صورت شبانه روزی با کارشناسان این مجموعه به شماره تلفن 88882222-021 ارتباط برقرار کرده و مشاوره دریافت نمایید.
احتساب قیمت باتری ها در مجموعه کیان باتری به همراه دریافت باتری فرسوده انجام می شود اما در صورت نیاز می توانید باتری فرسوده را نزد خود نگه داشته و در این صورت قیمت باتری جدید شما بدون احتساب دریافت باتری فرسوده محاسبه خواهد شد.
مقاله جالبی هست خیلی خوب استفاده کردم دست مریزاد