عملکرد سنتی باتری در محفظه موتور به خوبی شناخته شده است: بدون باتری نمی توان وسیله نقلیه را راه اندازی کرد. علاوه بر موتور استارت ، شمع ، شمع گرمکن ، چراغ ها و برنامه های الکترونیکی همه به انرژی الکتریکی احتیاج دارند.
اما باتری چگونه ساخته می شود و چگونه کار می کند؟
باتری های اسید سرب: قطعات و ساختار
بسیاری از رانندگان هنگام خرید جدید ، از وزن سنگین باتری خودرو آگاه می شوند. وزن باتری از حدود 10.5 کیلوگرم ، تا 30 کیلوگرم متغیر است. دلیل این امر صفحات سربی است که در سلولهای باتری استفاده شده است.
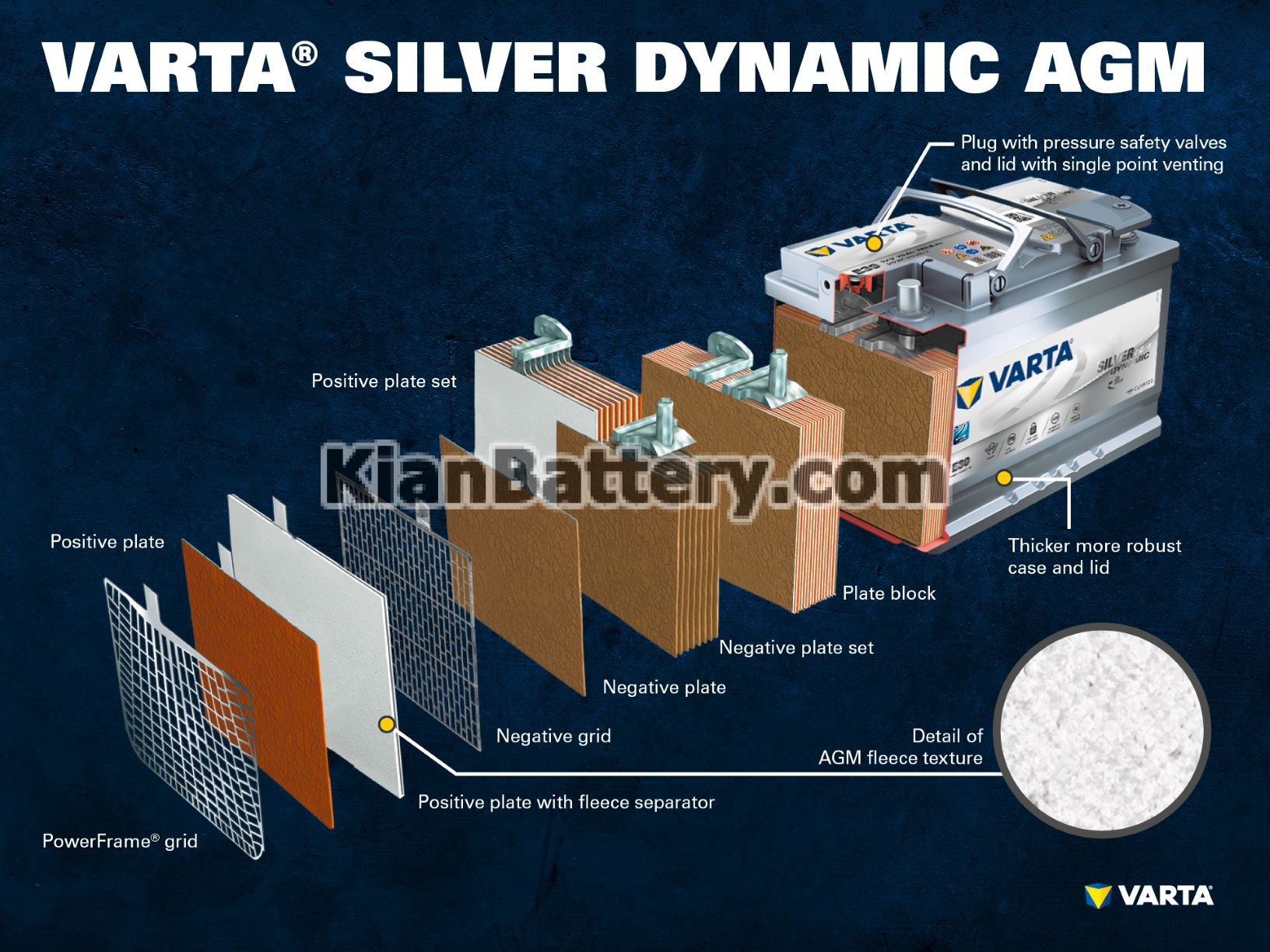
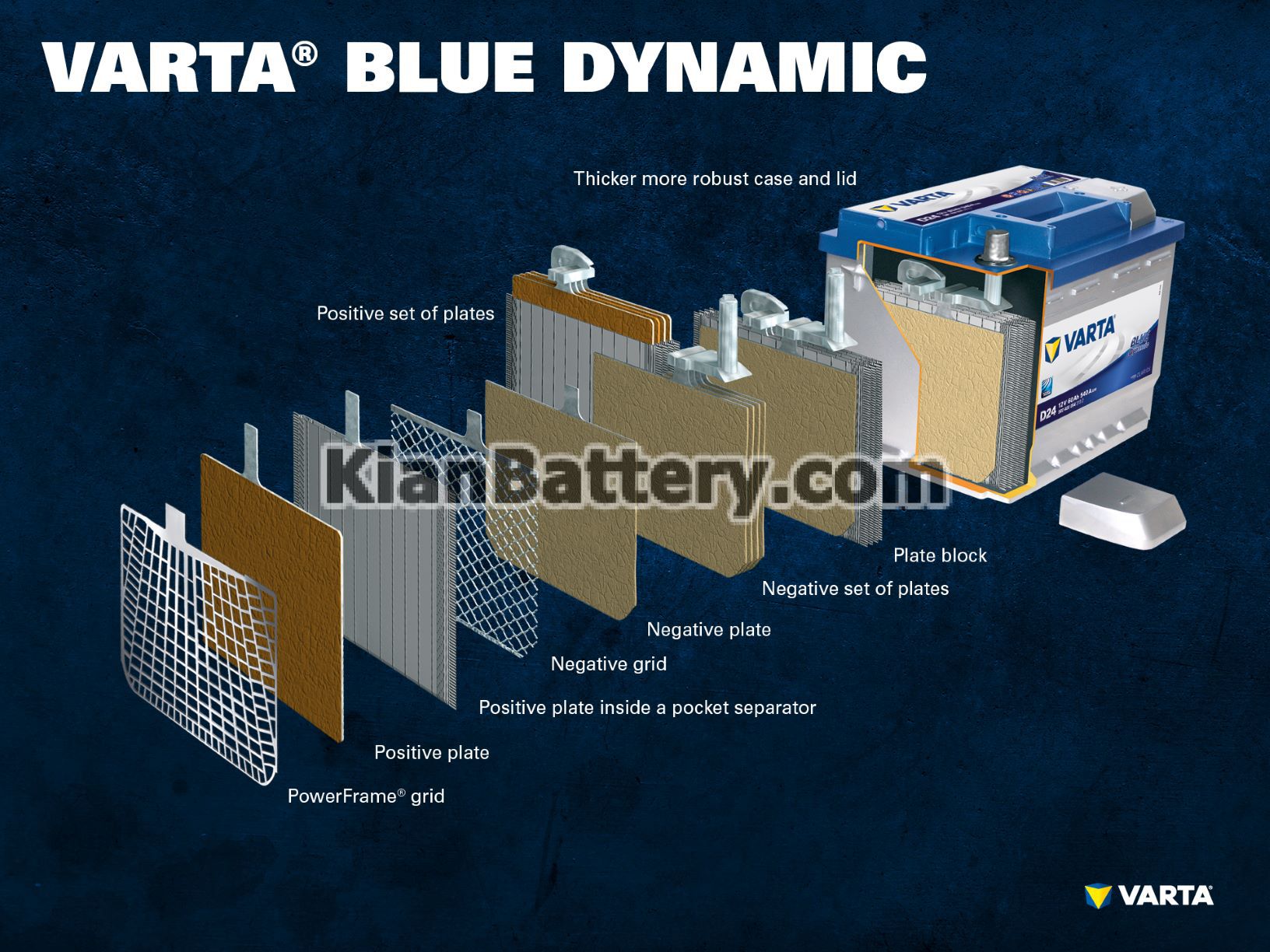
قطعات و ساختار سلول باتری
الکترود مثبت:
صفحه مثبت: در باتری سرب اسیدی ، صفحه با بار مثبت (ماده فعال) از اکسید سرب (PbO2) تشکیل شده است که در یک الکترولیت غوطه ور است.
شبکه مثبت: شبکه مثبت از آلیاژ سرب تشکیل شده است و برای نگه داشتن ماده فعال و به عنوان یک جمع کننده فعلی استفاده می شود.
الکترود منفی:
صفحه منفی: صفحه با بار منفی (ماده فعال) از سرب خالص (Pb) تشکیل شده است ، که در یک الکترولیت نیز فرو رفته است.
شبکه منفی: این نیز مانند صفحه مثبت ، از آلیاژ سرب تشکیل شده و در همان هدف نیز بکار گرفته می شود.
الکترولیت ترکیبی از اسید سولفوریک (H2SO4) و آب مقطر است. این الکترولیت می تواند به صورت مایع (مانند باتری های مرطوب معمولی یا در فن آوری پیشرفته EFB) ، یا به شکل ژل باشد یا در یک نمد شیشه ای محدود شود (مانند فن آوری AGM).
چندین الکترود مثبت، دسته صفحه مثبت را تشکیل می دهند و چندین الکترود منفی دسته صفحه منفی را تشکیل می دهند. با هم ، یک صفحه منفی و یک صفحه مثبت یک بلوک صفحه را تشکیل می دهند که هر بلوک داخل یک سل باتری قرار داده می شود.
یک باتری استارت معمولی از 6 سلول متصل به سری است که هر کدام دارای ولتاژ اسمی 2 ولت هستند که در صورت شارژ کامل باتری ، ولتاژ دقیقا 12.72 ولت حاصل می شود. ظرفیت و قابلیت آمپر سرد باتری از تعداد صفحات در هر سلول ناشی می شود.
سلول ها در یک محفظه قرار دارند که از پلاستیک مقاوم در برابر اسید (پلی پروپیلن) ساخته شده است. در یک باتری SLI معمولی ، این با یک پوشش با یک سیستم لایبرنیت بسته می شود که مانع از خروج مایع از باتری می شود و مایع را از گاز جدا می کند.
باتری های اولیه دارای سل های پیچ دار بودند که می بایستی آب باتری هر چند وقت به آن اضافه میشد. اما باتری های کنونی از نوع سیلد هستند و نیاز به ریختن آب باتری ندارند.
عملکرد باتری اتومبیل: انرژی شیمیایی به انرژی الکتریکی تبدیل می شود.
باتری ماشین انرژی را به صورت شیمیایی ذخیره می کند و آن را به انرژی الکتریکی تبدیل می کند. در این فرآیند الکترو شیمیایی ، چهار ماده با یکدیگر واکنش نشان می دهند:
هیدروژن (H)
اکسیژن (O2)
سرب (Pb)
سولفور (S)
اتصال مصرف کننده خارجی ، واکنش شیمیایی موجود در باتری را شروع می کند:
الکترولیت ، ترکیبی از اسید سولفوریک (H2SO4) و آب مقطر به یون های هیدروژن با بار مثبت (H +) و یون های سولفات با بار منفی (SO42-) تبدیل می شود.
در همان زمان ، الکترونها (2e-) از منفی به الکترود مثبت از طریق مصرف کننده خارجی حرکت می کنند.
برای جبران این جریان الکترون ها ، یون های سولفات از الکترولیت به الکترود منفی حرکت می کنند ، جایی که با سرب (Pb) واکنش نشان می دهند تا سولفات سرب (PbSO4) تولید کنند.
سولفات سرب نیز در الکترود مثبت تولید می شود: پیوند اکسیژن (O2) در اکسید سرب (PbO2) با انتقال الکترون شکسته می شود و اکسیژن به داخل الکترولیت منتقل می شود.
سرب باقی مانده (سرب) با سولفات (SO4) از الکترولیت پیوند می یابد.
در آنجا اکسیژن با هیدروژن پیوند می یابد تا آب (H2O) تشکیل شود. از آنجا که از اسید سولفوریک با تشکیل سولفات سرب استفاده می شود ، غلظت محلول الکترولیت کاهش می یابد. هنگامی که غلظت اسید سولفوریک به زیر سطح مشخصی سقوط کند ، باید باتری آن را شارژ کرد.
در حین شارژ ، فرآیندهای شیمیایی به ترتیب معکوس انجام می شوند. در انتها می توان عناصر اصلی را یافت: الکترود مثبت از سولفات سرب (PbSO4) تشکیل شده است ، الکترود منفی از سرب خالص (Pb) و الکترولیت متشکل از اسید سولفوریک رقیق (H2SO4) است. از آنجا که این فرایند تبدیل با ضرر همراه است ، یک باتری تنها می تواند تعداد محدودی از چرخه های شارژ را تحمل کند. بنابراین عمر مفید آن محدود است.
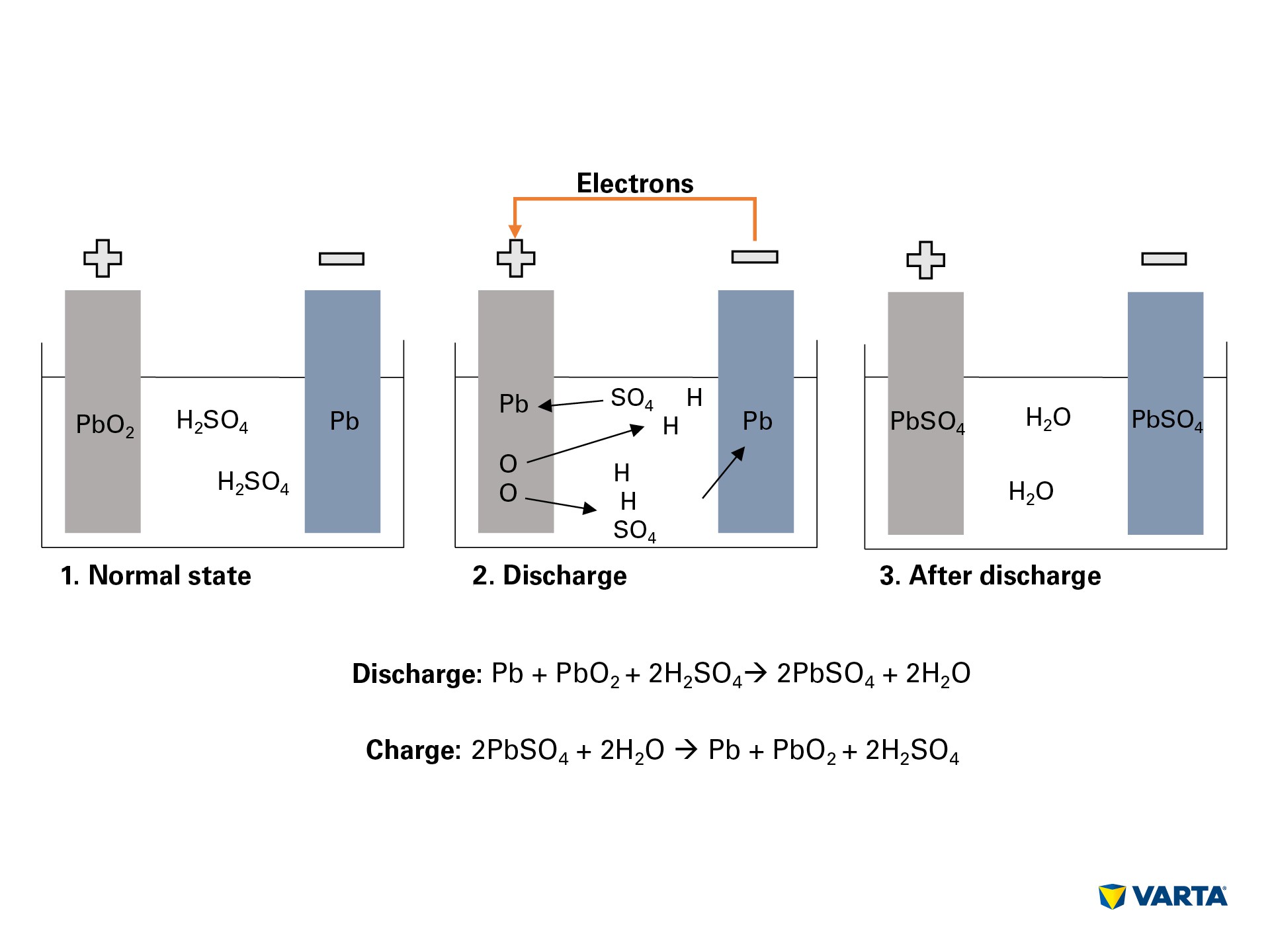
فرمول :
Discharge: Pb + PbO2 + 2H + 2HSO4 —-> 2PbSO4 + 2H2O
Charge: 2PbSO4 + 2H2O —-> Pb + PbO2 + 2H2SO4
مشکلات باتریهای اسید سرب: سولفاته شدن و لایه بندی اسیدها
اگر یک باتری با ولتاژ خیلی کم شارژ شود ، اسید موجود در الکترولیت به دلیل اختلاط ضعیف طبقه بندی می شود. تراکم های مختلف، باعث لایه بندی اسید سولفوریک در قسمت پایین و آب در قسمت بالای باتری می شود. به همین دلیل ، تنها بخش میانی الکترولیت ، یعنی فقط یک سوم الکترولیت، می تواند برای فرآیند تخلیه و شارژ مورد استفاده قرار گیرد.
علت احتمالی لایه بندی اسیدها عمدتا سفرهای کوتاه با استفاده همزمان تعداد زیادی از بخش های خودرو هست که برق مصرف می کنند. در این حالت ، آلترناتور زمان کافی برای شارژ مجدد باتری را ندارد.

نتیجه لایه بندی اسید سولفات است.
اگر این اتفاق در باتری رخ دهد ، یا اگر مرتباً در حد کافی شارژ نشود ، سولفات سرب (PbSO4) روی الکترودها متبلور می شود که در طی زمان ساختارهای بلوری بزرگتری را تشکیل می دهند. این فرایند به عنوان “سولفاته” شناخته می شود. بلوری شدن (کریستالیزه شدن) از تبدیل مجدد سولفات سرب به عناصر اصلی سرب یا اکسید سرب جلوگیری می کند ، که منجر به جلوگیری از پذیرش بار و کاهش قدرت جریان هوای سرد CCA می شود.
سولفاته شدن همچنین ممکن است به لایه جداکننده (separators) آسیب برساند و یا باعث اتصال کوتاه در سلول شود.
برای خنثی کردن این تأثیر و جلوگیری از خرابی زودرس باتری ، هیچگاه نباید یک باتری در طی مدت طولانی در حالت کم شارژ نگهداری شود. به همین منظور توصیه می شود باتری را به طور مرتب تست کنید و در صورت لزوم آن را به طور کامل شارژ کنید.
فن آوری های جدید باتری: AGM و یون لیتیوم
تاکنون ، باتری های معمولی اسید سرب سهم بالایی از بازار را به خود اختصاص داده اند.
با این حال ، بازار به سرعت در حال تغییر است: در فن آوری های نو مثل خودروهای مجهز به سامانه خاموش-روشن از باتریهایی مانند AGM استفاده می کنند که باعث ایجاد ثبات در چرخه بیشتر و تضمین عملکرد قابل اعتماد در وسایل نقلیه با افزایش انرژی مورد نیاز می شوند.
یکی دیگر از مزایای AGM این است که لایه بندی اسید داخل باتری اتفاق نمی افتد.
نسل جدیدی از باتری های اتومبیل برای وسایل نقلیه میکرو هیبریدی با ولتاژ 48 ولت عمل می کند و از سلول هایی با فناوری یون لیتیوم استفاده می کنند.